
L'ACTUALITÉ EN CANCÉROLOGIE VUE PAR GUSTAVE ROUSSY
Newsletter #5 - février 2021
Hématologie
Utilisation de cellules Natural Killer allogéniques génétiquement modifiées dans les hémopathies B CD19+
David Ghez
Les auteurs d’une étude publiée dans le New England Journal of Medicine rapportent les résultats d’un essai de phase I ayant évalué l’efficacité et la tolérance de cellules Natural Killer (NK) de sang de cordon transduites avec un vecteur rétroviral codant pour un CAR anti-CD19 et un « gène suicide ».
Onze patients présentant des hémopathies B en rechute ou réfractaires (six lymphomes B et cinq LLC dont deux syndromes de Richter) ont reçu une injection de cellules NK CAR anti-CD19 après une lymphodéplétion par fludarabine et cyclophosphamide. Il était permis aux investigateurs de démarrer un traitement de post rémission dès J30 post-injection.
Une toxicité hématologique réversible, imputable au conditionnement, a été observée chez tous les patients. Aucun syndrome de relargage cytokinique ni d’atteinte neurologique n’est survenu. En l’absence de toxicité sévère, il n’a pas été nécessaire d’activer le gène suicide pour éliminer les NK CAR. Comme avec les lymphocytes T CAR, une déplétion lymphocytaire B a été observée chez tous les patients.
Avec un suivi médian de 13,8 mois, une réponse a été observée chez huit patients (73 %) dont sept réponses complètes (RC). Chez un 8e patient avec une LLC compliquée d’un syndrome de Richter, le traitement par NK CAR a permis l’obtention d’un rémission complète pour le lymphome de haut grade mais pas de la LLC. Parmi ces huit patients, cinq ont reçu un traitement de post-rémission et demeurent en RC.
Un pic d’expansion des NK CAR a été observé entre J3 et J14, avec une persistance des NK CAR > 12 mois. La survenue d’une réponse est associée à une expansion précoce des NK. Aucune réaction du greffon contre l’hôte ni apparition d’anticorps anti-HLA n’ont été observées.
Référence :
Enri Liu, et al. Use of CAR-Transduced Natural Killer Cells in CD19-Positive Lymphoid Tumors. NEJM 2020. doi: 10.1056/NEJMoa1910607
Hématologie
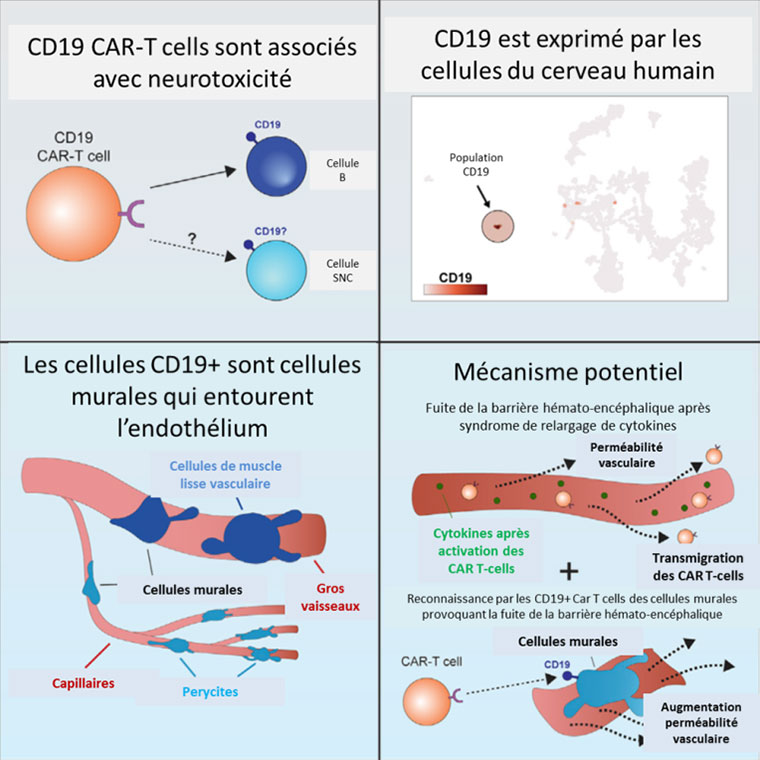
L’expression de CD19 dans les cellules murales musculaires lisses vasculaires stabilisant l’endothélium vasculaire du cerveau impliquée dans la neurotoxicité des CD19 CAR T-cells.
Cristina Castilla Llorente
La physiopathologie de la neurotoxicité des immunothérapies dirigées contre CD19 - Car T-cells ou anticorps bispécifiques (BITEs) - n’est pas claire. Une étude publiée dans Cell met en évidence qu’avec l’utilisation de « single cell RNA sequencing data », les cellules murales qui entourent l’endothélium cérébral expriment CD19. Cette expression pourrait être l’origine de l’effet « on-target » des immunothérapies anti-CD19.
Les immunothérapies dirigées contre CD19, telles que les lymphocytes T génétiquement modifiés, appelés « CAR (chimeric antigen receptor)-T cells », et les anticorps bispécifiques (BITEs) ont démontré des résultats cliniques favorables dans le traitement des hémopathies lymphoïdes B en rechute ou réfractaires aux traitements conventionnels1. L’un des effets secondaires les plus redoutés et plus fréquents reste les complications neurologiques appelées « neurotoxicité ». La cause exacte et les mécanismes sous-jacents de cette neurotoxicité restent inconnus.
Dans cette étude, les auteurs montrent que certaines cellules qui entourent les vaisseaux dans le cerveau, appelées les cellules « murales » du cerveau humain expriment le marquage CD19. Cette expression de CD19 est probablement l’origine de cet effet « on-target » des immunothérapies qui ciblent le CD19. C’est grâce à une nouvelle technologie à base d’ARN appelée le « single cell RNA sequencing data » que les auteurs ont montré que les cellules murales – les péricytes ainsi que les cellules de muscle lisse vasculaire (vSMC) - qui entourent l’endothélium cérébral, et qui sont indispensables pour maintenir l’intégrité de la barrière hématoencéphalique, expriment CD19.
Le type de marqueur CD19 identifié sur les cellules murales est l'isoforme CD19 qui contient l’épitope FMC63 reconnu par les cellules CAR-T et BiTEs CD19 utilisés actuellement en clinique.
Références :
1. June, C.H., O’Connor, R.S., Kawalekar, O.U., Ghassemi, S., and Milone, M.C.(2018). CAR T cell immunotherapy for human cancer. Science 359,1361–1365.
2. Parker KV , Migliorini D , Perkey E, Yost KE , Bhaduri A , Bagga P, Haris M , Wilson NE, Liu F , Gabunia K , Scholler J , Montine TJ , Bhoj VG, Reddy V, Mohan S , Maillard I , Kriegstein AR , June CH , Chang JY , Posey AD , Satpathy AT Single-Cell Analyses Identify Brain Mural Cells Expressing CD19 as Potential Off-Tumor Targets for CAR-T Immunotherapies. 2020 Oct 1;183(1):126-142.e17. doi: 10.1016/j.cell.2020.08.022. Epub 2020 Sep 21.
Sarcomes
Ripretinib, une nouvelle arme thérapeutique dans les tumeurs stromales gastro-intestinales avancées
Antoine Italiano
Les tumeurs stromales gastro-intestinales (GIST) sont caractérisées dans près de 90 % des cas par une mutation activatrice des gènes KIT ou PDGFRα leur conférant une sensibilité à l’imatinib, inhibiteur de tyrosine kinase, dont l’introduction au début des années 2000 a littéralement bouleversé la prise en charge des patients concernés par cette tumeur rare.
Ce médicament entraîne ainsi un bénéfice clinique durable chez 80 % des patients, ce bénéfice étant variable en fonction du profil mutationnel de la tumeur. Néanmoins, une grande majorité d’entre eux vont présenter une progression de leur maladie malgré la poursuite du traitement du fait d’une résistance, le plus souvent en rapport avec la survenue de mutations secondaires du récepteur c-Kit. Le sunitinib et le regorafenib par leur action inhibitrice sur les récepteurs de la famille VEGF et PDGFβ présentent une puissante activité anti-angiogénique outre leur activité anti-tumorale directe via l’inhibition des récepteurs KIT et PDGFRα. Ces inhibiteurs de tyrosine kinase ont ainsi respectivement obtenu une autorisation de mise sur le marché en 2e et 3e ligne de traitement. Il n’existait jusqu’à présent aucun traitement validé après échappement à ces traitements.
Le ripretinib est également un puissant inhibiteur de KIT et PDGFRA ayant montré une activité clinique significative à la posologie > 100 mg/jour (taux de progression à 6 mois de 57 %) dans une étude de phase I ayant inclus 109 patients atteints de GIST. Une étude de phase III versus placebo chez des patients en situation d’échec après trois lignes de traitements vient d’être rapportée.
La survie médiane sans progression était de 6,3 mois (intervalle de confiance de 95 % [IC] = 4,6 –6,9 mois) dans le groupe ripretinib vs 1,0 mois (IC à 95 % = 0,9 –1,7 mois) dans le groupe placebo (rapport de risque [HR] = 0,15, IC à 95 % = 0,09–0,25, P < 0,0001). La survie sans progression estimée à 6 mois était de 51 % contre 3 %. Le bénéfice du ripretinib était constant dans tous les sous-groupes examinés, y compris en fonction du nombre de lignes antérieures (3 lignes : HR = 0,15, IC à 95 % = 0,08–0,29 ; aux quatre lignes : HR = 0,24, IC à 95 % = 0,12 – 0,51) thérapies antérieures.
Référence :
Blay JY, Serrano C, Heinrich MC, Zalcberg J, Bauer S, Gelderblom H, Schöffski P, Jones RL, Attia S, D'Amato G, Chi P, Reichardt P, Meade J, Shi K, Ruiz-Soto R, George S, von Mehren M. Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2020 Jul;21(7):923-934. doi: 10.1016/S1470-2045(20)30168-6. Epub 2020 Jun 5. Erratum in: Lancet Oncol. 2020 Jul;21(7):e341. PMID: 32511981.
TNE
Le ciblage de l’épigénétique, une nouvelle perspective thérapeutique dans les tumeurs neuroendocrines bien différenciées, résultats de la phase I de l’inhibiteur du LSD1, CC-90011
Julien Hadoux et Antoine Hollebecque pour le comité TNE
La caractérisation moléculaire des tumeurs neuroendocrines bien différenciées (TNE) a révélé l’importance des altérations épigénétiques et des gènes impliqués dans la méthylation de l’ADN et le remodelage de la chromatine. C’est sur ce rationnel que l’étude de phase I de l’inhibiteur de la déméthylase lysine-spécifique I (LSD1) a inclus des patients atteints de TNE avec des résultats prometteurs.
Les tumeurs neuroendocrines sont caractérisées par une des altérations des gènes de l’épigénétique (1–3). Les études de génomique intégrative ont révélé que les TNE pulmonaires en particulier présentent des altérations fréquentes de gènes impliqués dans les modifications d’histones (méthylation, déméthylation, acétylation) et dans le remodelage de la chromatine (protéines du complexe SWI/SNF) ce qui en fait de bonnes candidates à des traitements à visée épigénétiques.
Le CC-90011 est un inhibiteur de la déméthylase lysine-spécifique 1 (LSD1) qui a un rôle pléïotropique de répresseur transcriptionnel par déméthylation de la lysine 4 des histones et d’activateur transcriptionnel par déméthylation de la lysine 9. Cette molécule a été évaluée au DITEP dans une étude de phase I menée par le Dr Hollebecque avec une 1re phase d’escalade de dose et une 2e phase d’expansion de dose dont l’objectif principal était d’évaluer le profil de tolérance de la molécule et la dose recommandée pour les futures études de phase II (4).
Les patients étaient éligibles selon les critères de phase I habituels et s’ils étaient porteurs d’un lymphome non hodgkinien avancé ou d’une tumeur solide avec un enrichissement de la population par des patients porteurs de néoplasmes neuroendocrines (tumeurs neuroendocrines bien différenciées mais également peu différenciées).
Le CC-90011 était administré par voie orale une fois par semaine. Au total, 50 patients d’âge médian 61 ans ont été inclus dont 49 porteurs de tumeurs solides, parmi lesquels 27 avaient un néoplasme neuroendocrine. La dose recommandée de phase II a été déterminée à 60 mg/semaine et la dose maximale tolérée était de 80 mg/semaine. La toxicité de grade 3-4 principale était la thrombopénie (20 % des patients), non compliquée de saignement et répondant aux diminutions de dose. Les autres toxicités de grade 3-4 étaient la neutropénie (8 %) et la fatigue (2 %). Le patient porteur de lymphome de la zone marginale a présenté une réponse complète (depuis 164 semaines) et, parmi les tumeurs solides, sept stabilisations de plus de 6 mois ont été observées. Les durées de traitement les plus longues ont été observées chez des patients porteurs de TNE bien différenciées bronchiques*. Ces stabilisations prolongées sont synonymes d’efficacité thérapeutique puisque les patients avaient une maladie progressive avant inclusion.
Alors que le rationnel de l’inhibition de LSD1 avait été développé principalement dans des modèles précliniques de carcinomes neuroendocrines peu différenciés, cette étude de phase I relance l’intérêt du ciblage de l’épigénétique dans les TNE, en particulier bien différenciées. Les résultats cliniques du CC-90011 avec stabilisations prolongées sont similaires aux réponses observées habituellement avec les traitements standards, comme les analogues de la somatostatine, chez ces patients porteurs de maladie à évolution lente. Le profil de tolérance satisfaisant et l’administration per os une fois par semaine du CC-90011 en font un bon candidat pour ce profil de patient, en particulier après progression sous analogues de la somatostatine, par exemple. Le développement clinique actuel de cette molécule est encore principalement axé sur les carcinomes neuroendocrines peu différenciés mais nul doute qu’une évaluation en phase II est nécessaire chez nos patients atteints de TNE bien différenciées.
* Pour les TNE, deux patients ont une stabilité de plus de 84 semaines et une réponse partielle est observée chez un patient avec une tumeur fibreuse solitaire qui a débuté l’essai il y a 176 semaines.
Références :
1. Scarpa A, Chang DK, Nones K, Corbo V, Patch A-M, Bailey P, et al. Whole-genome landscape of pancreatic neuroendocrine tumours. Nature. 2 mars 2017;543(7643):65‑71.
2. Fernandez-Cuesta L, Peifer M, Lu X, Sun R, Ozretić L, Seidal D, et al. Frequent mutations in chromatin-remodelling genes in pulmonary carcinoids. Nat Commun. 27 mars 2014;5:3518.
3. Alcala N, Leblay N, Gabriel A a. G, Mangiante L, Hervas D, Giffon T, et al. Integrative and comparative genomic analyses identify clinically relevant pulmonary carcinoid groups and unveil the supra-carcinoids. Nat Commun. 20 2019;10(1):3407.
4. Hollebecque A, Salvagni S, Plummer R, Isambert N, Niccoli P, Capdevila J, et al. Phase I Study of Lysine-Specific Demethylase 1 Inhibitor, CC-90011, in Patients with Advanced Solid Tumors and Relapsed/Refractory Non-Hodgkin Lymphoma. Clin Cancer Res Off J Am Assoc Cancer Res. 15 janv 2021;27(2):438‑46.
Digestif
Cancer du rectum : une prise en charge ultra-personnalisée
Léonor Benhaim, Jérôme Durand-Labrunie et Michel Ducreux
Présentées au congrès de l’ASCO 2020, les études Rapido et Prodige 23 ouvrent un nouveau standard dans la prise en charge des cancers du rectum localement avancés (T3 ou T4).
Le standard thérapeutique était jusqu’alors une radiothérapie (avec ou sans chimiothérapie) suivie de chirurgie. Dans l’essai français Prodige 23, le schéma expérimental comprenait une chimiothérapie d’induction par Folfirinox suivi d’une radiochimiothérapie (50 Gray). Il était comparé au traitement de référence en France : radiochimiothérapie (50 Gray). Dans cette étude à laquelle Gustave Roussy a largement participé, la survie sans récidive à 3 ans était supérieure dans le bras expérimental (78,8 % vs 71,7 % (HR 0.64, CI 0.44-0.93, p<0.02). On observait aussi une augmentation du taux de réponse histologique complète : 27,5 % vs 11.7 (p<0.001).
Dans l’essai des Pays-Bas Rapido, le schéma expérimental était différent, comprenant une radiothérapie courte (25 Gray) suivie d’une chimiothérapie par Folfox. Il était comparé au traitement de référence radiochimiothérapie (50 Gray). Il a été observé une diminution significative de la récidive à distance (8 % vs 20 %; HR 0.69, p=0.0048) et de la récidive locale (6 % vs 8,4 %) dans le bras expérimental.
Dans ces deux études, l’ajout d’une chimiothérapie au traitement permettait d’augmenter la survie des patients en comparaison au traitement de référence et devient donc une option thérapeutique. Les résultats sont à prendre avec mesure car la prise en charge des cancers du rectum reste complexe. Le taux de chirurgie avec mise en place de colostomie était très élevé dans l’étude Rapido alors qu’en France, la conservation sphinctérienne est un standard même pour des tumeurs avancées. Se pose aussi la question, dans le cadre de l’essai Norad, de la place de la radiothérapie en cas de tumeur avec marges d’exérèse chirurgicale prévisibles suffisantes (>2mm).
- Bahadoer R. R. et al.. Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol. 2021 Jan;22(1):29-42. doi: 10.1016/S1470-2045(20)30555-6. Epub 2020 Dec 7. Erratum in: Lancet Oncol. 2021 Feb;22(2):e42. PMID: 33301740.
- Conroy T. Prodige 23 (en cours de publication)
Génétique
BRCA1, BRCA2 et PALB2 confirmés comme les trois gènes majeurs à l’origine du risque très élevé de cancer du sein
Olivier Caron

Les tests génétiques peuvent être un outil puissant d’évaluation des risques de cancer du sein. Néanmoins, il n’est pas toujours simple de faire le tri parmi toutes les informations disponibles. Au-delà des gènes de prédisposition « historiques » comme BRCA1 ou BRCA2, l’association avec le risque de cancer du sein des anomalies de certains gènes moins connus repose parfois sur arguments fragiles. Les estimations des risques associés sont très souvent imprécises. En outre, les données concernant les risques par sous-type spécifique de cancer du sein sont presque inexistantes.
Le consortium international BCAC apporte des éléments de réponse par l’étude d’échantillons d’ADN de femmes atteintes ou non de cancer du sein et incluses dans 44 études nationales. Quatorze de ces protocoles sélectionnaient les participantes sur leur histoire familiale particulièrement lourde en cancers ; les trente autres n’avaient aucun critère de sélection et peuvent donc être considérées comme des études de population.
Le séquençage d’un panel de 34 gènes de prédisposition provenant des échantillons de 60 466 femmes atteintes d'un cancer du sein et de 53 461 témoins a confirmé que les variants tronquant les protéines des gènes BRCA1, BRCA2, ATM, CHEK2 et PALB2 étaient clairement associés à un risque significatif de cancer du sein (P< 0,0001), mais avec une ampleur d’augmentation de risque très variable (odds ratio de 2,1 à 10,5).
L’association avec des variants tronquants des gènes BARD1, RAD51C, RAD51D (odds ratio inférieurs à 2) et étonnamment TP53 était moins évidente. Pour ce dernier gène, il faut noter néanmoins les faibles effectifs (seulement sept cas), donnant des intervalles de confiance extrêmement larges.
Les variants tronquant les protéines des gènes ATM et CHEK2 étaient plus fortement associés au cancer du sein RE-positif, tandis que les variants tronquant les protéines des gènes BRCA1, BRCA2, PALB2, BARD1, RAD51C, et RAD51D étaient plus fortement associés au cancer du sein RE-négatif. Cette spécificité d’augmentation de risque par sous-type est un argument indirect venant conforter l’association. En revanche, 13 autres gènes ne montraient pas d’association avec le cancer du sein, avec des résultats non interprétables pour MSH2, MSH6 et NF1.
Cette étude d’une très grande ampleur, confirme que BRCA1, BRCA2 et PALB2 sont dans la catégorie des gènes « à haut risque » de cancer du sein, alors que ATM, CHEK2, BARD1, RAD51C, RAD51D seraient dans la catégorie « risque modéré ». Cette approche cas / témoin ne permet pas de conclure pour les gènes aux mutations trop rares comme TP53, CDH1, PTEN et STK11. Malgré tout, les intervalles de confiance sont très larges, rendant encore difficile l’utilisation de ces estimations en pratique courante. Des estimations de risque par approche familiale, avec test des apparentés, restent nécessaires, ce d’autant qu’elles s’affranchissent de la rareté des mutations. La grande variabilité des estimations peut également s’expliquer par la présence de cofacteurs génétiques. La combinaison de variants de ces gènes avec d’autres, notamment des SNP par des Polygenic Risk Scores (PRS), permettrait d’affiner encore les risques.
Référence :
Breast Cancer Risk Genes - Association Analysis in More than 113,000 Women. N Engl J Med. 2021 Feb 4;384(5):428-439.doi: 10.1056/NEJMoa1913948.
Pédiatrie
Les très bons résultats de l’essai de phase II des médulloblastomes de haut risques PNET-HR+5
Samuel Abbou
Les tumeurs cérébrales de l’enfant sont les premières tumeurs solides en incidence. Parmi elles, la plus fréquente est le médulloblastome. Bien qu'elle soit en cours d’évolution, la définition des tumeurs de haut risque reposait ces dernières années sur la qualité de la résection, le caractère métastatique, le sous type histologique et l’amplification des oncogènes MYC ou MYCN.
La stratégie de l’étude PNET-HR +5, développée à Gustave Roussy, a été évalué dans un protocole de phase II sur 18 centres français. Cinquante et un patients, âgés de 5 à 20 ans, présentant un médulloblastome de haut risque ont été traités. Une chirurgie était réalisée au diagnostic quand elle était faisable, suivi d’une chimiothérapie conventionnelle par deux cures de VP16-Barboplatine et d’une double intensification par chimiothérapie à haute dose (Thiotepa 600) avec support de cellule souche autologue. Puis, les patients recevaient une irradiation craniospinale de 36 Gy et de la tumeur primitive à 54 Gy. La dose de radiothérapie craniospinale était diminuée à 23,4 Gy pour les patients avec une maladie localisée, un résidu post-opératoire mais présentant une réponse complète après les cures de chimiothérapies. Un traitement d’entretien par six mois de temozolomide était proposé après la radiothérapie, quand la tolérance hématologique le permettait.
La survie sans progression et la survie globale sont de 76 % à 5 ans et ce sont les meilleurs résultats publiés dans les médulloblastomes de haut risque à ce jour. Avec ce traitement, les sous-groupes moléculaires de type SHH et groupe 3 étaient de plus mauvais pronostic que les groupe WNT et 4. Cette stratégie comporte une certaine toxicité aigüe qui peut être contrôlée et aucun décès toxique n’a été constaté.
Référence :
Dufour C, Foulon S, Geoffray A, Masliah-Planchon J, Figarella-Branger D, Guerrini-Rousseau L, Faure-Conter C, Icher C, Bertozzi AI, Leblond P, Akbaraly T, Bourdeaut F, André N, Chappé C, Schneider P, De Carli E, Chastagner P, Berger C, Lejeune J, Soler C, Entz-Werlé N, Delisle MB. Prognostic relevance of clinical and molecular risk factors in children with high-risk medulloblastoma treated in the phase 2 trial PNET HR+5. Neuro Oncol. 2020 Dec 30:noaa301. doi: 10.1093/neuonc/noaa301. Epub ahead of print. PMID: 33377141.
Abonnez-vous à la newsletter Good to Know
Ne manquez pas les prochains numéros de la newsletter Good to Know : abonnez-vous !
Crédits photos : Adobe Stock, Gustave Roussy.
