
L'ACTUALITÉ EN CANCÉROLOGIE VUE PAR GUSTAVE ROUSSY
Newsletter #9 - Juin 2021
Hématologie
Impact pronostique des co-variables génétiques chez les patients atteints de LAM avec mutations des gènes de l’IDH1 et IDH2, traités intensivement dans trois essais prospectifs du groupe ALFA.
Stéphane de Botton, Jean-Baptiste Micol
Les mutations hétérozygotes d’isocitrate déshydrogénase 1 et 2 (IDH1 et IDH2) concernent les résidus arginine R132 d’IDH1 ou R172 et R140 d’IDH2. Elles sont retrouvées dans environ 20 % des leucémies aiguës myéloïdes (LAM) de novo. Le pronostic de ces mutations en contexte de traitement par chimiothérapie intensive n’a pas été étudié avec les co-variables génétiques qui leur sont associées. De plus, les inhibiteurs des mutants d’IDH1 et IDH2 sont approuvés et leur association avec un traitement intensif en cours d’évaluation.
A partir de trois essais prospectifs de traitement intensif de LAM de novo du groupe Acute Leukemia French Association (ALFA), 127 cas de mutations IDH1, 135 d’IDH2R140 et 57 d’IDH2R172 ont été analysés incluant de la cytogénétique et un panel de 37 mutations de LAM par séquençage à haut-débit
En cas de mutation IDH1, la co-présence de mutations de NPM1 est la seule variable prédictive d’une meilleure survie globale en analyse multivariée (p < 0,0001). En cas de mutation IDH2R140, un caryotype normal (p= 0,008) et la présence de mutations NPM1 (p = 0,01) sont associées à une meilleure survie globale. En cas de mutation IDH2R172, le taux de plaquettes est la seule variable prédictive de la survie globale avec un seuil à 100 G/L (p = 0,002). L’allogreffe indiquée en cas de classification ELN -2010 non favorable, pratiquée en première rémission améliore significativement la survie globale (p = 0,03) et la survie sans évènement (p = 0,02) par rapport aux patients non greffés.
Au total, les futurs essais avec des inhibiteurs d’IDH associés à la chimiothérapie devront être stratifiés sur la présence de la mutation NPM1, principal facteur pronostic en cas de mutation IDH1 et IDH2R140 et sur l’allogreffe en première rémission.
Référence :
Duchmann M, Micol JB, Duployez N, Raffoux E, Thomas X, Marolleau JP, Braun T, Adès L, Chantepie S, Lemasle E, Berthon C, Malfuson JV, Pautas C, Lambert J, Boissel N, Celli-Lebras K, Caillot D, Turlure P, Vey N, Pigneux A, Recher C, Terré C, Gardin C, Itzykson R, Preudhomme C, Dombret H, de Botton S. Prognostic significance of concurrent gene mutations in intensively treated patients with IDH-mutated AML: an ALFA study. Blood. 2021 May 20;137(20):2827-2837. doi: 10.1182/blood.2020010165.
Sénologie
Inhibiteur de PARP adjuvant chez des femmes atteintes de cancer du sein localisé à haut risque en contexte de mutation germinale BRCA1/2
Anna Ilenko, Benjamin Verret
L’étude Olympia démontre pour la première fois l’intérêt d’un anti-PARP en situation adjuvante. L’ajout d’olaparib pendant un an en plus du traitement standard (traitement local, chimiothérapie, +/- hormonothérapie) chez des femmes atteintes de cancer du sein localisé à haut risque, en contexte de mutation des gènes BRCA1/2, diminue de 42 % le risque de rechute ou décès et de 43 % le risque de métastase ou décès, à 3 ans.
Les inhibiteurs de PARP ont déjà révolutionné la prise en charge des cancers de l’ovaire en cas de mutation BRCA1/2 (constitutionnelle ou tumorale). Dans le cancer du sein, l’intérêt ces traitements a déjà été démontré au stade métastatique chez des patientes porteuses de mutation constitutionnelle de BRCA1/2. L’étude Olympia comparait l’administration d’olaparib et d’un placebo, pendant un an en plus du traitement standard adjuvant chez des patient(e)s porteurs de mutation germinale BRCA1/2 et présentant un cancer du sein HER2 négatif à haut risque de rechute. Ont été considérés comme à haut risque les cancers du sein triple négatif de plus de 2 cm, N+ ou bien en non réponse complète après chimiothérapie néo-adjuvante, et les cancers du sein RH+/HER2- avec quatre ganglions envahis au moins, ou une mauvaise réponse à une chimiothérapie néo-adjuvante.
1 936 patients ont été inclus dans l’étude. A 3 ans, la prise d’olaparib améliorait très significativement le taux de survie sans rechute invasive (85,9 % vs 77,1 %, HR 0,58 (99.5 % CI, 0.41–0.82) p<0.001 ; bénéfice brut 8.8 %), ainsi que le taux de survie sans métastase (87,5 % vs 80,4 %, HR 0.57 (99.5 % CI, 0.39–0.83) p<0.001), avec une tendance à un taux de survie globale plus important (92 % vs 88,3 %, HR 0.68 (99 % CI, 0.44–1.05), p=0,02).
Le bénéfice de l’olaparib était retrouvé dans chaque sous-groupe (TNBC, luminal, post-néoadjuvant, etc.) et la toxicité acceptable avec essentiellement une asthénie et une anémie.
Cette étude démontre donc l’intérêt d’un traitement adjuvant par olaparib en cas de cancer du sein agressif chez des patients porteurs(ses) de mutations constitutionnelles de BRCA1/2. Compte-tenu de ces résultats, un challenge pour le futur proche sera donc de pouvoir obtenir de façon rapide le statut mutationnel BRCA1/2 constitutionnel chez toutes les personnes potentiellement éligibles.
Référence :
Tutt, A. N. J. et al. Adjuvant Olaparib for Patients with BRCA1 - or BRCA2 -Mutated Breast Cancer. N. Engl. J. Med. NEJMoa2105215 (2021) doi:10.1056/NEJMoa2105215.
Essais précoces
CHRYSALIS a déjà éclos : sur une autorisation de mise sur le marché
Stéphane Champiat, Daphné Morel, Loïc Verlingue
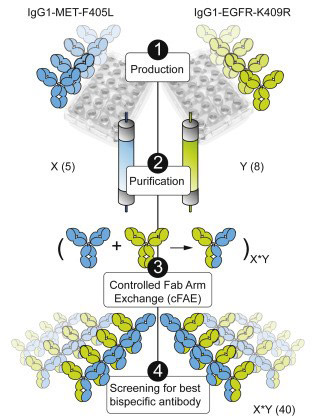
L’amivantamab est un anticorps monoclonal bispécifique ciblant à lui seul deux anomalies majeures retrouvées fréquemment dans certains cancers : EGFR et cMET. Fin mai 2021, l’amivantamab a reçu une autorisation de mise sur le marché accélérée aux États-Unis chez les patients atteints de cancer du poumon non à petites cellules avec mutation par insertion de l’exon 20. Cette autorisation fait suite aux résultats impressionnants de l’essai de phase I CHRYSALIS, dont la phase II est toujours ouverte au recrutement au DITEP.
L’amivantamab est le premier anticorps monoclonal bispécifique à être autorisé (aux États-Unis) dans le traitement de seconde ligne des patients atteints de cancer du poumon non à petites cellules avec insertion de l’exon 20 sur EGFR, qui est une mutation de pronostic défavorable, avec seulement 8 % de patients toujours en vie 5 ans après le diagnostic. En comparaison, les patients avec une mutation d’EGFR L858R ou une délétion de l’exon 19 présentent un taux de survie à 5 ans de 19 %.
Dans l’essai pivot de phase I CHRYSALIS, le taux de réponse globale fut de 40 % chez les 81 patients traités, dont 3,7 % de réponses complètes et 36 % de réponses partielles.
L’amivantamab est un anticorps 100 % humain, alors que la plupart des anticorps actuellement utilisés en clinique sont dits « humanisés », c’est-à-dire qu’ils sont à 90 % humain et à 10 % murin. D’un point de vue clinique, il est théoriquement attendu que l’anticorps humain provoque moins d’effets secondaires qu’un anticorps humanisé. Dans CHRYSALIS, tout de même 84 % des patients ont présenté un rash, 64 % une réaction liée à l’infusion, 50 % des paronychies (inflammation de la peau du pli de l’ongle), 47 % des douleurs musculosquelétiques, 37 % une dyspnée, 36 % des nausées, 33 % une fatigue, 27 % des œdèmes, 26 % une stomatite (inflammation des muqueuses de la bouche), 25 % une toux, 23 % une constipation, 22 % des vomissements (pour ne citer que les effets > 20 % d’incidence). Lors de son administration en routine, il est donc prévu que l’amivantamab soit donné systématiquement avec une prémédication par paracétamol, antihistaminique et corticoïdes.
Pour l’autorisation européenne, le laboratoire a déposé le dossier règlementaire pour demander l’obtention de la mise sur le marché, mais il faudra surement attendre d’avoir un peu plus de recul sur les données de survie.
Références :
Discovery of amivantamab (JNJ-61186372), a bispecific antibody targeting EGFR and MET. Neijssen J. et al. J Biol Chem. 2021 Apr 8;296:100641.
Communiqué de presse :
RYBREVANTTM (amivantamab-vmjw) Receives FDA Approval as the First Targeted Treatment for Patients with Non-Small Cell Lung Cancer with EGFR Exon 20 Insertion Mutations.
Rubrique
SELECT prédit la réponse aux thérapies à partir du transcriptome des tumeurs
Stéphane Champiat, Daphné Morel, Loïc Verlingue
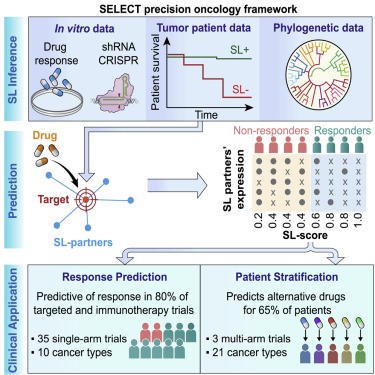
Le projet SELECT a tiré parti de nombreuses databases publiques de données moléculaires (notamment de transcriptome) et cliniques pour générer un programme capable de stratifier les patients en fonction de leur potentiel de réponse aux thérapies ciblées et immunothérapies, à partir de leurs données moléculaires tumorales. Testé sur les données issues de 35 essais cliniques non randomisés (principalement phases I/II), l’outil s’est montré prédictif de réponse dans 80 % des cas. L’essai WINTHER, dont Gustave Roussy fut promoteur, a notamment servi de validation.
L’objectif du projet SELECT était d’arriver à prévoir la réponse d’un patient pour un traitement donné, à partir du transcriptome de la tumeur réalisé sur la biopsie, au moment du diagnostic. Le projet a compris deux parties : une première partie où, pour chaque médicament, des cibles moléculaires tumorales d’intérêt ont été identifiées sur la base du principe de létalité synthétique (la survie de la cellule dépend du bon fonctionnement de A et/ou B, et si A et B sont absents, la cellule meurt), puis une seconde partie où chaque interaction entre une cible d’origine tumorale et une cible médicamenteuse est évaluée sur des données réelles de patients, afin d’en étudier l’intérêt en pratique.
Pour l’étude, les auteurs ont collecté les données transcriptomiques et cliniques (réponse au médicament) de 3 925 patients, ayant reçu une parmi 13 types de chimiothérapies, 14 types de thérapies ciblées ou 21 types d’immunothérapies. En tout, 13 localisations tumorales étaient représentées.
Une fois leur modèle en place, les auteurs l’ont évalué sur les données issues de l’essai WINTHER, un essai basket dirigé par Gustave Roussy où les patients se voyaient proposé une thérapie ciblée personnalisée en dehors des indications classiques, si le transcriptome de leur tumeur indiquait qu’une mutation était « actionnable » par ce traitement. De manière intéressante, l’outil SELECT a pu identifier des traitements alternatifs d’intérêt pour 65 % des patients.
La validation prospective de SELECT pourrait permettre de proposer de nouvelles options thérapeutiques à des patients pour qui, à l’heure actuelle, il n’existe pas de solution personnalisée pour traiter leur cancer avancé.
Référence :
Synthetic lethality-mediated precision oncology via the tumor transcriptome. Lee J.S et al. Cell. 2021 Apr 29;184(9):2487-2502.e13.
ORL
Une méta-analyse en réseau pour améliorer la prise en charge de cancers ORL localement avancés
Claire Petit

La prise en charge des carcinomes épidermoïdes ORL repose sur un traitement multimodal associant traitement locorégional par chirurgie et/ou radiothérapie et qui peut être combiné à de la chimiothérapie avec différents timings. Les méta-analyses classiques MACH-NC et MARCH ont montré le bénéfice de la chimiothérapie concomitante, de l’association taxane-platine et 5-FU (TaxPF) en induction et de la radiothérapie avec modification du fractionnement. Qu’advient-il lorsque l’on réalise une méta-analyse en réseau pour déterminer les efficacités relatives des différents traitements ?
Une méta-analyse en réseau permet une analyse groupée de tous les essais randomisés, réalisés dans une situation clinique donnée, en utilisant les informations directes et indirectes disponibles pour déterminer l’efficacité relative des traitements.
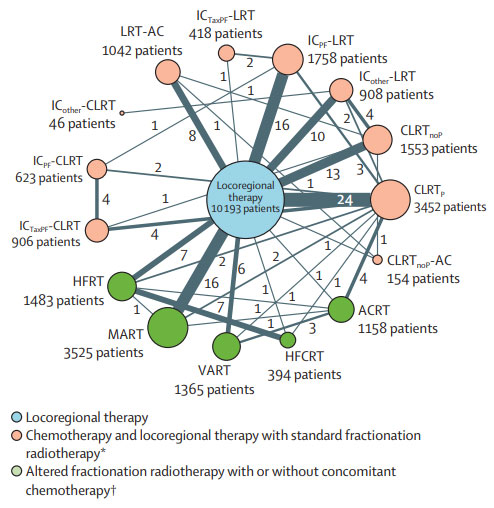
Pour cette méta-analyse en réseau, les bases de données MACH-NC (MetaAnalysis of Chemotherapy in Head and Neck Cancer) et MARCH (Meta-Analysis of Radiotherapy in Carcinomas of Head and Neck) ont été utilisées. Au total, la méta-analyse en réseau sur données individuelles a combiné les informations de 115 essais randomisés, ce qui correspond à 28 978 patients et a permis d’individualiser 16 modalités de traitement. Le suivi médian basé sur les essais était de 6,6 ans (écart interquartile 5,0–9,4 ans).
Les analyses ont montré que la radiothérapie hyperfractionnée avec chimiothérapie concomitante se classe au premier rang pour la survie globale, la survie sans évènement, le contrôle locorégional et la survie liée au cancer, avec des résultats globalement robustes aux analyses de sensibilité. Comparé au traitement locorégional, cette modalité de traitement a un P-score de 97 % et un hazard ratio à 0,63 [IC 95 % 0,51–0,77]. Pour le contrôle métastatique, les modalités avec chimiothérapie adjuvante sont mieux classées. Les autres modalités qui sont bien classées sont la chimiothérapie d'induction de type TaxPF avec un traitement locorégional avec ou sans chimiothérapie concomitante ainsi que la radiothérapie accélérée avec chimiothérapie concomitante.
Les stratégies d’intensification thérapeutique que sont la radiothérapie hyperfractionnée avec chimiothérapie concomitante ou la chimiothérapie d’induction de type TaxPF suivi d’une radiochimiothérapie concomitante apparaissent améliorer l’efficacité thérapeutique et sont des alternatives thérapeutiques à considérer en particulier chez les patients ayant des tumeurs non liées à l’HPV.
Référence :
Petit C, Lacas B, Pignon J-P, Le QT, Grégoire V, Grau C, et al. Chemotherapy and radiotherapy in locally advanced head and neck cancer: an individual patient data network meta-analysis. Lancet Oncol. 2021;22(5):727‑36.
Abonnez-vous à la newsletter Good to Know
Ne manquez pas les prochains numéros de la newsletter Good to Know : abonnez-vous !
Crédits photos : Adobe Stock, Gustave Roussy.
