Plasticité métabolique en physiopathologie
Cette équipe est rattachée à l’UMR 9018 Aspects métaboliques et systémiques de l’oncogenèse pour de nouvelles approches thérapeutiques (METSY)
Notre équipe étudie le rôle des mitochondries dans la plasticité métabolique des cellules cancéreuses dans le but de découvrir de nouveaux biomarqueurs et de proposer de nouvelles stratégies thérapeutiques qui pourraient améliorer la réponse des tumeurs aux traitements anticancéreux. En effet, par leur contribution à la bioénergétique, la synthèse des macromolécules, et des métabolites, la réponse au stress et la mort cellulaire programmée, les mitochondries jouent un rôle important dans la tumorigenèse et la réponse aux traitements anticancéreux.
Thèmes de recherche de l’équipe
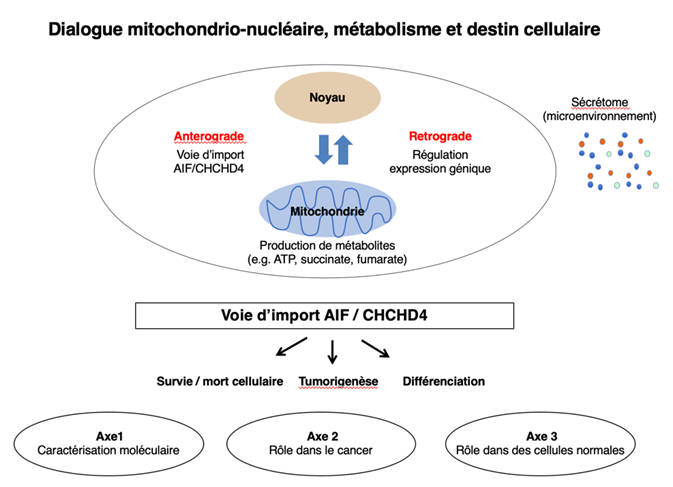
La plasticité métabolique est une capacité fondamentale qui permet aux cellules d'adapter leur statut métabolique à des besoins spécifiques pendant la prolifération, la différenciation, l'activation en réponse à divers stimuli ou en réponse à des conditions de stress. Dans ce contexte, les mitochondries sont des acteurs majeurs par leur contribution au métabolisme. L'activité mitochondriale est finement régulée par un dialogue bidirectionnel avec le noyau. En premier lieu, un dialogue antérograde (du noyau vers les mitochondries) contrôle la biogenèse mitochondriale en permettant l'import de plus de 1000 protéines dans l'un des quatre sous-compartiments de l'organite. En retour, à travers la production d'ATP et d'autres métabolites, les mitochondries établissent un dialogue rétrograde avec le noyau (de la mitochondrie au noyau) et impactent l'expression des gènes qui sont impliqués dans des processus cellulaires essentiels. La perturbation du dialogue mitochondrio-nucléaire et le dysfonctionnement mitochondrial pourraient être à l'origine de la signalisation du stress ou contribuer au développement de conditions pathologiques telles que le cancer ou les pathologies neurodégénératives. L'objectif général de nos recherches est de comprendre les mécanismes moléculaires qui sont impliqués dans la plasticité métabolique et qui pourraient avoir une influence sur le destin cellulaire et la réponse au stress, en réaction aux traitements anticancéreux (radio- ou chimiothérapie) ou à l'exposition à stimuli physiques comme les champs électriques ou électromagnétiques.
Notre programme (axes n°1 à n°3) est dédié à la voie d'import mitochondrial AIF/CHCHD4, qui joue un rôle crucial dans le dialogue mitochondrio-nucléaire antérograde. Cette voie d'import, dont le composant central est le complexe AIF/CHCHD4, permet l'import d'une famille de protéines qui sont impliquées dans la survie cellulaire, l'adaptation au stress et la réponse aux stimuli induisant la mort cellulaire. Nos objectifs sont de mieux comprendre le rôle de ces protéines dans la plasticité métabolique des cellules normales et tumorales et d'exploiter les connaissances acquises par la génération d’outils moléculaires pour la découverte de nouveaux biomarqueurs et la proposition de nouvelles cibles thérapeutiques et de molécules anticancéreuses à combiner avec les stratégies thérapeutiques conventionnelles. L'axe n°4 est dédié à l'exploration et à la caractérisation des conséquences biologiques de l'exposition de cellules à des stimuli physiques.
Axe n°1 : Caractérisation moléculaire du complexe AIF/CHCHD4 pour son ciblage thérapeutique. Ici, nous cherchons à comprendre les voies de signalisation qui régulent l’interaction entre les protéines AIF et CHCHD4 (N. Modjtahedi /Coll. N. Doti, CNR Naples / Italie), et générer des nano-outils pour inhiber le complexe dans la mitochondrie (G. Urbinati/ Coll. F. Treussart LuMIn, CNRS & ENS, Univ. Paris-Saclay ; J. Spadavecchia CSPBAT CNRS ; Univ. Paris XIII ; et R. Gref, ISMO, UMR 8214 CNRS, Univ. Paris-Saclay). Grâce à un criblage haut débit, nous identifions et étudions des molécules interrompant l’interaction AIF/CHCHD4 et ainsi affectant le métabolisme, le destin des cellules cancéreuses et la réponse à la chimiothérapie. L'analyse structurale du complexe AIF/CHCHD4 par modélisation moléculaire permettra de proposer un modèle d’interaction AIF/CHCHD4 en 3 dimensions, de réaliser un criblage virtuel de peptides et le docking moléculaire des ligands d’AIF (C. Brenner/ Coll. B. Figadère et Tâp Ha-Duong, CNRS BIOCIS, Univ Paris-Saclay, Inca Interpedia). Les molécules les plus prometteuses sont développées pour le traitement de l’ostéosarcome afin d’exploiter de nouvelles vulnérabilités métaboliques liées à des défauts de la voie AIF/CHCHD4 et de la signalisation du calcium (C. Brenner/ Coll. B. Georger, N. Gaspar et A. Marchais ; INSERM U1015, Gustave Roussy, essais cliniques MAPPYACTS et BOOS T-dataS, SFCE).
Axe n°2 : Impact de la voie AIF/CHCHD4 sur le métabolisme tumoral. Les mitochondries étant désormais reconnues comme des acteurs clés dans la plasticité métabolique des cellules cancéreuses et dans la détection et la propagation de signaux générés soit par les cellules tumorales, soit par le microenvironnement tumoral, nous étudions par des manipulations génétiques et pharmacologiques, le rôle de la voie AIF/CHCHD4 dans le métabolisme tumoral, la tumorigenèse, la réponse aux agents thérapeutiques et la résistance aux traitements anticancéreux (N. Modjtahedi/ Coll. F. Milliat, IRSN).
Axe n°3 : Bases métaboliques de la différenciation des cellules souches. La plasticité métabolique est fondamentale pour le contrôle de l'homéostasie des cellules souches et la régulation de la capacité de ces cellules à se différencier vers des lignages cellulaires spécifiques. Dans le cadre de cet axe, nous étudions la régulation de la voie d'import AIF/CHCHD4 au cours de la différenciation des cellules souches et évaluons son impact sur la capacité des mitochondries à adapter leur activité aux besoins métaboliques et bioénergétiques des cellules souches qui traversent les étapes d’activation, prolifération et différenciation (N. Modjtahedi / Coll. R. Mounier, B. Chazaud et A. Kneppers; Inst. NeuroMyogène, Univ. Lyon 1).
Axe n°4 : Conséquences biologiques de l'exposition des cellules à des stimuli physiques. L'objectif général est d'utiliser des champs électriques ou électromagnétiques pour modifier la perméabilité des membranes cellulaires et des organelles de manière contrôlée, et de l'exploiter pour développer des applications dans le domaine de l'oncologie ou des thérapies cellulaires. Dans l'un de nos projets, nous étudions les mécanismes spécifiques des impulsions électriques sub-nanosecondes avec l'objectif à plus long terme de développer des applications qui contribueront à améliorer l'utilisation de l'électrochimiothérapie et de l'électroporation irréversible en clinique (F. André & L. Mir /Collab. L. Pecastaing, Univ. Pau). La recherche clinique sur l’électrochimiothérapie est portée par le Dr. Frédéric Deschamps (département de Radiologie Interventionnelle de Gustave Roussy), sur des applications spécifiques de l'électrochimiothérapie aux métastases osseuses dans la colonne vertébrale, avec d'excellents résultats de traitement. Un autre aspect de notre programme concerne le contrôle du destin des cellules souches par la manipulation non-pharmacologique, par voie électrique de l'oscillation du calcium cytosolique. Notre objectif est de développer des applications dans le domaine de l'oncologie ainsi que de la médecine régénérative (F. André & L. Mir /Collab dans le cadre du projet européen FET-Open RISEUP consortium coordonné par C. Consales, ENEA, Italie).
Notre laboratoire est équipé d'un analyseur Seahorse (XFe96, Agilent) et d'un lecteur d'images Cytation (Agilent), qui permet de mesurer simultanément et en temps réel les principales voies énergétiques de la cellule. Ces instruments sont regroupés sur une plateforme d'analyse du métabolisme cellulaire du laboratoire METSY labellisée par Agilent et accessible aux collaborateurs externes (Responsable scientifique : catherine.brenner@universite-paris-saclay.fr ; responsable technique : Romain.FERNANDES@gustaveroussy.fr). Nos travaux s'appuient sur les plateformes gérées par l'UMS AMMICA de Gustave Roussy (UMS-3655/INSERM-US23) ainsi que la plateforme de criblage à haut débit CIBLOT, labellisée IBISA, qui fait partie de Criblage@ParisSaclay et de l'infrastructure nationale de Chembiofrance.