Vieillissement du tissu hématopoïétique
Cette équipe est rattachée à l’UMR 1287 - Cellules souches hématopoïétiques et développement des hémopathies myéloïdes
Thème de recherche
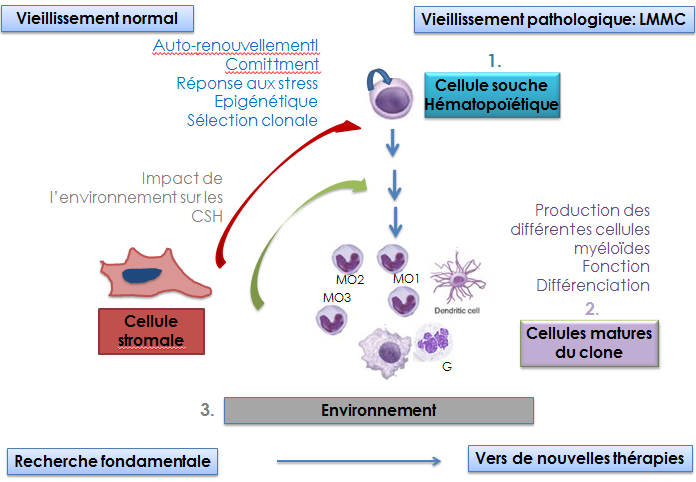
La population mondiale vieillit. Cette évolution démographique suscite l’exploration approfondie des effets physiopathologiques du vieillissement, l’un d’entre eux étant l’émergence d’affections malignes. Le vieillissement du tissu hématopoïétique, par exemple, modifie la composition et les fonctions des cellules sanguines, altère l'immunité innée et adaptative, contribue à l’émergence de cytopénies isolées et de maladies chroniques, et prédispose au développement d’hémopathies malignes telles que syndromes myélodysplasiques (SMD), néoplasmes myéloproliféraifs (NMP), et leucémies aigües myéloïdes (LAM). L’étude de l’impact moléculaire, cellulaire et tissulaire du vieillissement devrait suggérer des stratégies de prévention et de détection précoce de ces maladies.
L’équipe explore l’impact du vieillissement sur la différenciation myélomonocytaire. Nous étudions les mécanismes moléculaires de la différenciation, à partir des cellules souches hématopoïétiques (CSH), des cellules de la lignée myélomonocytaire, avec un intérêt particulier pour la nature, la fonction, le devenir des différentes populations des monocytes matures. Notre programme vise à décrypter l’évolution des CSH et des cellules myéloïdes sous l’effet de variations intrinsèques (modifications géniques, dérégulation du génome non codant, évolution épigénétique) et extrinsèques, qu’il s’agisse des changements du microenvironnement ou de facteurs plus éloignés comme les variations dans la composition du microbiote. Nous explorons l’évolution de ces processus dans le contexte normal, au cours des stress et dans un contexte pathologique : la leucémie myélomonocytaire chronique (LMMC), une hémopathie myéloïde modèle car 1) typiquement associée au vieillissement 2) associant une composante dysplasie à une composante proliférative. Ce projet se situe à l’interface de différentes pathologies : cancer, pathologies cardiovasculaires, immunité/inflammation/infection. En explorant la physiopathologie de la LMMC, il doit aussi générer des approches thérapeutiques nouvelles, les explorer dans des modèles précliniques et les transférer à la clinique grâce aux liens étroits avec l’unité de phase I de Gustave Roussy et les équipes médicales du groupe Francophone des Myélodysplasies.
La transdisciplinarité enrichit notre travail. Nous accueillons dans l’équipe une chercheuse du CNRS Philosophe des Sciences afin d’explorer avec un autre regard la question de l’identité des CSH normales et leucémiques et de l’évolution clonale. Nous avons aussi lancé un essai clinique visant à établir en partenariat un modèle mathématique de production de monocytes qui générera des hypothèses mécanistes et quantitatives pour guider notre recherche biologique.
Réponses aux stress et vieillissement normal et pathologique des CSH (Emilie Elvira-Matelot, Françoise Porteu)
Au cours du vieillissement, une pression de sélection s’exerce sur les CSH sous l’effet de multiples stress et sélectionne les clones les plus compétitifs, conservant leur capacité d’auto-renouvellement mais résistant au stress. C’est à partir de ces clones sélectionnés que s’effectue la transformation oncogénique. Ces dernières années, nous avons montré que, dans une CSH soumise à un stress génotoxique, la cytokine Thrombopoïétine (TPO) augmente la fidélité et l’efficacité de la réparation de l’ADN utilisant la voie « Non-Homologous End Joining (NHEJ) » en stimulant la DNA-PK (de Laval et al., Cell Stem Cell 2013 & Blood 2014). Nous avons mis en évidence un nouveau mécanisme moléculaire impliqué dans le vieillissement prématuré des CSH : l’intervention des rétro-éléments (RE). Cette réponse est contrôlée par la TPO via l’induction d’une réponse antivirale. (Barbieri et al., J Exp Med 2018). Nos projets combinent des approches expérimentales fondamentales appliquant des stress inflammatoires et génotoxiques chez la souris et des modèles humains, ainsi que l'étude des CSH de patients atteints de LMMC comme maladie modèle du vieillissement du système hématopoïétique pour étudier les liens entre la dynamique de la chromatine, la réparation de l'ADN, les modifications et la signalisation des cytokines dans le vieillissement des CSH et la sélection clonale. Nous étudions aussi les relations entre les rétro-éléments, l’instabilité génomique et l’immunité anti-tumorale.
Vieillissement de la lignée monocytaire (Nathalie Droin, Dorothée Selimoglu-Buet, Eric Solary)
L’une des conséquences du vieillissement du tissu hématopoïétique est la dégradation de la réponse immunitaire innée et adaptative (immuno-sénescence), notamment du fait d’une altération du nombre et des fonctions des cellules impliquées. Les monocytes du sang périphérique représentent entre 5 et 10% des leucocytes circulants. Ce sont des cellules clefs de la réponse innée et adaptative. Une des cytokines clefs de la monocytopoïèse est CSF1. Nous avons montré qu’une fraction de son récepteur, CSF1R, est localisée dans le noyau des monocytes et macrophages et participe à la régulation transcriptionnelle (Bencheikh et al., Nat Commun 2019).
Les monocytes sont hétérogènes. Une nomenclature internationale distingue 3 populations dans le sang. Notre équipe a identifié une anomalie de répartition de ces populations chez les patients atteints de LMMC (Selimoglu-Buet et al., Blood, 2015). Nous avons démontré qu'une voie miR-150 / TET3, conservée chez la souris et l'homme, contribuait à la répartition anormale des monocytes circulants dans la LMMC (Selimoglu-Buet et al., Nat Commun 2018).
Nous étudions l’impact du vieillissement sur la lignée monocytaire en recherchant comment le vieillissement des monocytes et des macrophages qui en dérivent 1) affecte les fonctions nucléaires de CSF1R ; 2) contribue aux modifications de la niche médullaire et affecte la CSH, notamment la conformation de la chromatine, la polarisation et la capacité de différenciation myéloïde et d’auto-renouvèlement en réponse au stress. Nous poursuivons l’exploration de l’hétérogénéité monocytaire via 1) la création d’un atlas des populations monocytaires en situation normale et pathologique; 2) l’analyse de la versatilité des monocytes humains; 3) la caractérisation des fonctions des populations nouvellement identifiées; 4) l’identification des mécanismes moléculaires gouvernant l’hétérogénéité monocytaire.
Physiopathologie et traitement de la LMMC (Eric Solary, Nathalie Droin, Dorothée Selimoglu-Buet)
Nous avons exploré les limites de l’efficacité des agents hypométhylants, démontrant que, par leur effet épigénétique, ces molécules restaurent une hématopoïèse équilibrée mais n’éliminent pas les altérations génétiques ni ne préviennent l’évolution génétique du clone et la transformation ultime de la maladie chronique en leucémie aiguë (Merlevede et al., Nat Commun 2016). Ces résultats soulignent l’importance des altérations épigénétiques dans l’expression clinico-biologique de la maladie et la nécessité d’identifier d’autres approches thérapeutiques pour éradiquer le clone malade. Nous avons modélisé la LMMC in vitro en reprogrammant des cellules CD34+ de patients en cellules souches (Beke et al., Haematologica 2020) et in vivo modèle de xénogreffe de cellules de patients LMMC chez la souris immunodéprimée (Zhang et al., Blood Advances 2018). Nous poursuivrons l’étude de la physiopathologie de la LMMC et la recherche de solutions thérapeutiques: 1) la contribution des mutations récurrentes des régions codantes de l’ADN à l’expression clinique et biologique de la LMMC, notamment en générant des modèles murins génétiquement modifiés; 2) le rôle des cellules matures du clone leucémique et de leurs effets immunosuppresseur et pro-inflammatoire ; 3) la contribution des altérations de la niche hématopoïétique à l’installation ou la progression de la LMMC.
Philosophie des Sciences (Lucie Laplane)
Nous pensons que la philosophie peut contribuer à la science grâce à l’analyse conceptuelle (Laplane et al. PNAS 2019). Nous développons 3 axes de recherches associés aux recherches expérimentales de l’équipe : les cellules souches, le microenvironnement tumoral et l’évolution clonale. Les évènements génétiques somatiques qui caractérisent le clone leucémique dans la LMMC s’accumulent dans le compartiment des cellules souches. Ces cellules, que l’on pourrait qualifier de « cellules souches leucémiques », semblent être la meilleure cible thérapeutique au sein du clone. Notre travail indique qu’une cellule souche peut appartenir à 4 catégories en fonction du caractère intrinsèque ou extrinsèque de la propriété souche, de sa dépendance ou de son indépendance vis-à-vis de l’environnement. La catégorie à laquelle appartient une cellule souche peut évoluer au cours de la maladie et nécessiter des stratégies thérapeutiques différentes (Laplane and Solary., Elife. 2019). L’identité et la quantité des cellules souches leucémiques peut impacter les dynamiques clonales (Laplane, Biology and Philosophy 2019). Nous cherchons à mieux caractériser et intégrer les différents processus évolutifs à l’œuvre dans l’évolution clonale, au cours du vieillissement (hématopoïèse clonale) et de la transformation maligne, notamment dans la LMMC (évolution génétique, évolution épigénétique, dynamiques cellulaires). Enfin, le microenvironnement occupe une place de plus en plus centrale en cancérologie et en biologie des cellules souches. Néanmoins les frontières spatiales du microenvironnement sont floues et le concept recouvre des contributions causales hétérogènes que nous cherchons à mieux caractériser (Laplane et al., Int J Cancer. 2019 ; Trends in Cancer 2018).