Mécanismes de réparation de l'ADN et cancérogenèse.
Cette équipe est rattachée à l’UMR 9019 CNRS - Intégrité du génome et cancer.
Les activités de recherche de l'équipe visent à décrypter les mécanismes de réparation des lésions complexes de l'ADN afin de mieux comprendre le développement du cancer, en particulier du cancer du rein, et les mécanismes de chimiorésistance des cellules tumorales en utilisant la complémentarité et l'expertise des membres de l'équipe. Les connaissances acquises grâce aux études mécanistiques des voies alternatives de réparation de l'ADN et des modifications post-réplicatives de l'ADN permettraient de développer de nouvelles cibles diagnostiques et thérapeutiques pour concevoir des inhibiteurs de la réparation de l’ADN afin de combattre la résistance acquise dans les cancers, en particulier dans le carcinome rénal qui servira de modèle.
Thèmes de recherche
L'équipe "Mécanismes de réparation de l'ADN et carcinogenèse" a pour objectif d'étudier les différents aspects de l'enzymologie de la réparation des dommages endogènes et exogènes de l'ADN dans les cellules et son implication dans la carcinogenèse et la résistance à la chimiothérapie des cellules cancéreuses (intrinsèques ou acquises), en particulier des cellules cancéreuses rénales. Les caractéristiques cliniques de certaines pathologies humaines héréditaires liées à des défauts de la réparation de l'ADN mettent en évidence la nature complexe des lésions oxydatives endogènes de l'ADN, qui comprennent des adduits encombrants et des pontages inter-brins de l'ADN (PIBs). D'autre part, les effets biologiques particulièrement sévères des rayonnements ionisants et des agents de pontage de l'ADN sont corrélés à la formation de lésions complexes dans l’ADN cellulaire. Les données génétiques et biochimiques indiquent que l'élimination des lésions complexes de l'ADN nécessite plusieurs voies distinctes de réparation de l'ADN, telles que la réparation par excision de bases (BER), la réparation par incision de nucléotides (NIR), la réparation par excision de nucléotides (NER), la réparation des mésappariements, la recombinaison homologue et non-homologue et la synthèse translésionnelle de l'ADN.
Les patients présentant des tumeurs inopérables et des métastases précoces, comme les cancers du sein et du poumon, sont souvent traités par une combinaison de chimio- et de radio-thérapie. Initialement, les cellules cancéreuses sont généralement chimio- et radio-sensibles ; Cependant, elles peuvent rapidement acquérir après 3 à 12 mois une chimio- et une radio-résistance. Par conséquent, la résistance acquise des cellules tumorales aux traitements reste un obstacle fondamental à l'obtention d'une efficacité maximale de la chimio- et de la radio-thérapie pour les cancers avancés. En particulier, le carcinome rénal à cellules claires (ccRCC) se caractérise par une hypoxie intra-tumorale et une chimiorésistance. Les agents chimio-thérapeutiques conventionnels sont inefficaces pour le traitement des ccRCC en raison de la résistance inhabituelle des cellules tumorales aux lésions de l'ADN, probablement due à l'activation des mécanismes de réparation de l'ADN. Ainsi, le cancer du rein nous offre un modèle pour étudier le rôle de la réparation de l'ADN dans la genèse et la résistance aux thérapies anticancéreuses des ccRCC. Il est à noter que les facteurs de transcription inductibles par l'hypoxie HIF1α et HIF2α jouent un rôle crucial dans l'initiation et la progression des ccRCC. Plus d’une centaine de gènes sont surexprimés lorsque les facteurs HIFs sont stabilisés dans les ccRCC, ce qui entraîne la croissance tumorale, la néo-vascularisation, l'invasion et la formation de métastases. Les facteurs HIFs sont intimement liés aux facteurs de réponse aux dommages de l'ADN.
Actuellement, les mécanismes conduisant à la résistance acquise aux chimio- et radio-thérapies des cellules tumorales ne sont pas encore complètement compris. Parmi les mécanismes possibles, l'activation des voies de réparation de l'ADN est une hypothèse intéressante. Le développement clinique de médicaments ciblant la réparation de l'ADN en tant que composés anticancéreux a été conçu autour du concept de létalité synthétique, dans lequel l'efficacité dépend du fond génétique des cellules en ce qui concerne la compétence des voies de réparation. Les inhibiteurs des poly(ADP-ribose) polymérases (PARP) représentent l’exemple le plus connu de la létalité synthétique. Par exemple, l'inhibition de la PARP1 s'est avérée le traitement le plus efficace pour les cellules tumorales présentant une recombinaison homologue défectueuse, en raison de mutations dans les gènes BRCA-1 et BRCA-2. Ainsi, la compréhension des mécanismes des voies de réparation de l'ADN apportera de nouvelles connaissances sur la résistance acquise des cellules tumorales et aidera à développer de nouvelles stratégies pour combattre les cancers.
L'objectif principal de notre équipe est d'explorer les mécanismes moléculaires des dommages et de la réparation de l'ADN liés à la cancérogenèse et à la chimio/radiorésistance. Nous nous concentrons sur deux grandes objectifs :
- les mécanismes moléculaires et le rôle des nouvelles voies alternatives de la réparation de l’ADN identifiées par notre équipe dans la résistance thérapeutique des cellules cancéreuses, et
- le rôle de la réparation des lésions complexes de l'ADN dans les prédispositions familiales au cancer. Pour répondre à ces questions, notre équipe mène des recherches sur les trois axes décrits ci-dessous :
Axe 1: Identification et caractérisation des voies alternatives de réparation de l'ADN pour les lésions complexes de l'ADN qui sont impliquées dans la transformation maligne et la résistance aux traitements anticancéreux.
Le traitement des lésions complexes de l'ADN implique généralement plusieurs voies de réparation de l'ADN qui se chevauchent et qui doivent être coordonnées dans le temps et l’espace. Les lésions complexes de l'ADN peuvent être réparées par différentes voies en fonction du type de cellule et de la nature de la lésion. Auparavant, nous avons établi plusieurs nouveaux mécanismes alternatifs de réparation des lésions complexes de l'ADN :
- Excision des pontages ADN-ADN et protéines-ADN par des ADN glycosylases humaines NEIL1 et NEIL3 (voir Figure 1);
- Élimination des adduits encombrants de 8,5'-cyclo-2'-désoxypurines par la protéine humaine APE1;
- Réparation aberrante, propice aux erreurs, des dommages oxydatifs des bases de l'ADN par les Thymine-ADN glycosylases humaine TDG et MBD4. Bien que ces mécanismes de réparation alternatifs aient l'avantage d'être rapides et simples, en utilisant peu d'étapes et peu d'énergie, par rapport aux voies de réparation classiques régulières, ils peuvent également conduire à une instabilité génétique. En effet, les cellules tumorales chimio- et radio-résistantes sont caractérisées par une instabilité génomique et par une sur-expression de APE1, NEIL3 et de PARP1.
Dans cet axe, nous aborderons deux questions majeures en utilisant le cancer du rein (ccRCC) comme modèle :
- Existe-t-il de nouvelles activités réparatrices non élucidées dans les cellules cancéreuses résistantes ?
- Quels sont les mécanismes de coordination de la réparation de l'ADN ? et la résistance acquise des cellules cancéreuses dépend-elle d’interactions protéine-protéine spécifiques et de modifications post-traductionnelles (PTM) ?
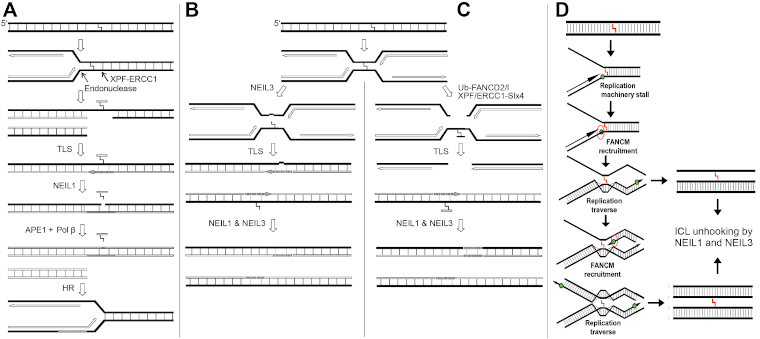
Figure 1. Réparation des pontages inter-brins de l’ADN couplée à la réplication de l’ADN. (A) NEIL1 excise l’oligomère décroché dans un intermédiaire à trois brins d’ADN. (B) NEIL3 et (C) la voie de l’Anémie de Fanconi conduisent la réparation des pontages inter-brins de l’ADN. (D) Le mécanisme hypothétique du contournement du pontage par la fourche de réplication de l'ADN médié par FANCM et la réparation des structures d'ADN à trois et quatre brins médiée par NEIL1 et NEIL3.
Axe 2: Étude d'une nouvelle modification post-réplicative de l'ADN par les poly(ADP-ribose) polymérases (PARPs) et de son rôle dans la réparation des cassures des brins d'ADN dans les cellules normales et cancéreuses.
Les enzymes PARP jouent un rôle majeur dans la réponse aux dommages de l'ADN et la réparation des cassures des brins d'ADN. La sur-activation de PARP1 est souvent associée à la résistance des cellules cancéreuses aux médicaments. Il est à noter que PARP1 interagit avec le facteur de transcription HIF et régule la réponse hypoxique médiée par les HIF in vivo.
Dans nos études précédentes :
- nous avons montré que les cellules cancéreuses résistantes au cisplatine manifestent une hyper-activation de PARP1 et une augmentation de la mort cellulaire lorsqu'elles sont exposées aux inhibiteurs PARP1, par rapport aux cellules cancéreuses sensibles au cisplatine (Michels et al, 2013) ;
- nous avons montré que in vitro les protéines humaines PARP1, 2 et 3 peuvent induire des liaisons covalentes entre les extrémités de l’ADN et de chaines de poly- et mono-ADP-ribose (Belousova et al, 2018 ; Talhaoui et al, 2016 ; Zarkovic et al, 2018) ;
- l’ADP-ribosylation de l'ADN catalysée par les PARPs est un processus réversible, cette modification covalent peut être rapidement dégradée par la Poly(ADP-ribose) glycohydrolase (PARG) (Talhaoui et al, 2016). Nos données préliminaires suggèrent que l’ADP-ribosylation des extrémités de l'ADN constitue une réponse cellulaire à des dommages complexes de l'ADN et peut être impliquée dans la coordination de la réparation de multiples cassures des brins d'ADN groupées.
Nos projets actuels visent à :
- caractériser les mécanismes de l'ADP-ribosylation de l'ADN par les PARPs;
- d'identifier les protéines responsables de la détection des adduits ADP-ribosylé de l'ADN;
- de rechercher la présence de l'ADN ADP-ribosylée dans les cellules cancéreuses exposées à divers traitements génotoxiques; (iv) de caractériser le rôle de l'ADP-ribosylation de l'ADN dans la réponse aux dommages de l'ADN et dans la coordination de la réparation des cassures des brins d'ADN dans les cellules normales et cancéreuses ainsi que dans la résistance acquise de ces dernières à la chimiothérapie.
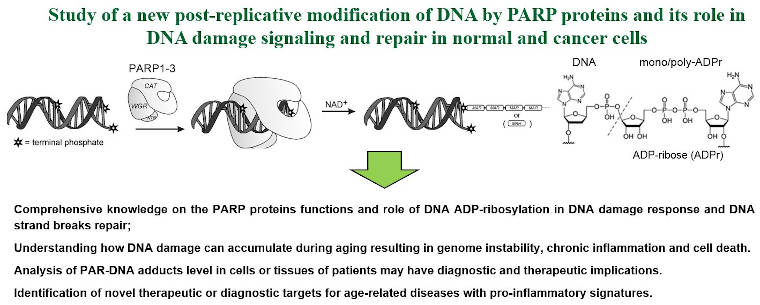
Figure 2. Étude d'une nouvelle modification post-réplicative de l'ADN par les protéines PARP.
Axe 3 : Étude des voies de signalisation induites par les dommages de l'ADN dans le cancer du rein et de leurs associations avec les cancers du rein héréditaires.
Bien que dans la plupart des cas les RCC se développent de façon sporadique, les prédispositions héréditaires représentent environ 3 % des cas. Des études approfondies sur les familles touchées par des cancers du rein héréditaire ont permis d'identifier 4 principaux gènes de prédisposition: 3 gènes suppresseurs de tumeurs VHL, FLCN et FH et 1 oncogène, MET. En outre, nous avons identifié, avec d'autres, des mutations germinales dans de nouveaux gènes : MITF, BAP1 et PBRM1 (Bertolotto et al, 2011 ; Popova et al, 2013 ; Benusiglio et al, 2015).
L'identification de la mutation causale des gènes de prédisposition aux RCC dans les familles offre la possibilité de procéder à des tests génétiques et permet de surveiller les porteurs de mutations, ce qui permet un diagnostic précoce et un meilleur pronostic. En outre, l'implication de la plupart des gènes de prédisposition aux RCC a été démontrée dans les RCC sporadiques, ce qui permet de mieux comprendre les différents mécanismes de la tumorigenèse rénale. C'est notamment le cas du gène VHL, également inactivé dans la plupart des RCC sporadiques. La protéine pVHL est essentielle pour l'angiogenèse: elle induit la dégradation de HIF dans des conditions de normoxie, la teneur normale de 3-5% (vol.) d'oxygène dans les tissus. La démonstration du rôle majeur de pVHL a ouvert la voie au développement de nouveaux médicaments spécifiques qui inhibent HIF et ses cibles transcriptionnelles, tels que les traitements anti-angiogéniques. Le cancer du rein est désormais considéré comme une maladie métabolique, car les gènes majeurs identifiés sont impliqués des voies qui convergent vers l'activation de HIF.
Le Réseau National de Référence pour les Cancers Rares de l'Adulte PREDIR (PREDIspositions aux tumeurs du Rein), coordonné par le Professeur S. Richard, est chargé du diagnostic génétique et de la gestion clinique des patients atteints de cancers du rein héréditaires avérés ou suspectés. Il nous permet d'accéder, après consentement éclairé, à des échantillons de tumeurs et à des échantillons de sang familiaux. Nous avons démontré un gradient de dysfonctionnement de la protéine pVHL dans les voies de signalisation de l'hypoxie (Couvé et al, 2014) et une dérégulation des profils des miARN et des ARNm dans les tumeurs rénales associées la maladie VHL (Gattolliat et al, 2018).
Récemment, nous avons identifié deux mutations faux-sens germinale dans deux familles différentes atteintes de RCC héréditaire dans un gène codant une protéine de réparation de l'ADN impliquée dans l'élimination des ICL, le maintien des télomères et la voie de l'anémie de Fanconi. Notre projet actuel vise à caractériser les formes mutées de ce gène au niveau cellulaire et tissulaire (rein normal et tumoral) et évaluer les conséquences fonctionnelles de ces mutations dans les cellules rénales après exposition aux traitements génotoxiques. A partir des échantillons de patients atteints de RCC héréditaire (sang et tumeurs), nous recherchons de nouvelles mutations dans des gènes impliqués dans la réponse aux dommages de l'ADN afin d’élucider les mécanismes moléculaires de la réparation des dommages de l'ADN associés à la carcinogenèse et à la chimio-/radio-résistance des cellules tumorales, en particulier dans le cancer du rein.

Figure 3. Cancer du rein (RCC) : gènes mutés, hypoxie intra-tumorale et chimiorésistance.
Le gène VHL est le principal gène de prédisposition aux RCC héréditaires. Ses mutations germinales prédisposent à la maladie de von Hippel-Lindau. On trouve également ce gène muté au niveau somatique dans la majorité des RCC sporadiques. Récemment, de nouveaux gènes mutés dans les RCC héréditaires ont été découverts tels que PBRM1, BAP1 et SETD2. PBRM1 est un membre du complexe de remodelage de la chromatine SWI-SNF et des articles récents ont établi un lien direct entre PBRM1 et HIF. BAP1 est une déubiquitinase dont le rôle a été signalé dans la réparation des dommages de l'ADN. SETD2 est une histone méthyltransférase dont on a récemment montré qu'elle régulait la réparation des mésappariements de l'ADN (MMR). Il est intéressant de noter qu'ils sont tous situés sur le chromosome 3p, qui est généralement délété dans les tumeurs rénales avec une perte d'hétérozygotie (LOH).
